Болезнь Паркинсона
и Мартина Файхтер, медицинский редактор и биологДоктор мед. Фабиан Синоватц - фрилансер в медицинской редакционной группе
Подробнее об экспертахМартина Файхтер изучала биологию в аптеке по выбору в Инсбруке, а также погрузилась в мир лекарственных растений. Оттуда было недалеко до других медицинских тем, которые все еще увлекают ее по сей день. Она обучалась журналистике в Академии Акселя Шпрингера в Гамбурге и работает в с 2007 года - сначала редактором, а с 2012 года - писателем-фрилансером.
Подробнее об экспертах Весь контент проверяется медицинскими журналистами.
При болезни Паркинсона некоторые нервные клетки головного мозга умирают. Пациенты могут двигаться только медленнее, мышцы становятся жесткими. В состоянии покоя руки и ноги начинают дрожать. Многие пациенты также имеют проблемы с мышлением и становятся безумными. Читайте здесь: Что такое болезнь Паркинсона? Кто пострадал? Как он выражает себя? Какие существуют варианты лечения?
Коды МКБ для этого заболевания: коды МКБ - это международно признанные коды медицинских диагнозов. Их можно найти, например, в письмах от врачей или в справках о нетрудоспособности. G21G22G20
Болезнь Паркинсона: краткий справочник
- Типичные симптомы: замедленность движений, малоподвижный образ жизни, ригидность мышц, тремор в покое, недостаточная устойчивость вертикальной позы, ригидность мимики.
- Причины: При болезни Паркинсона: клетки мозга, продуцирующие дофамин, погибают; при вторичной болезни Паркинсона: другие заболевания, лекарства или отравления; в случае генетически детерминированного синдрома Паркинсона: генетические изменения
- Обследования: физикальное и неврологическое обследование, L-допа-тест, компьютерная томография (КТ), спиновая томография керина (магнитно-резонансная томография, МРТ).
- Лечение: медикаменты (например, Levo-Dopa), физиотерапия, логопедия, трудотерапия, глубокая стимуляция мозга (DBS).
Болезнь Паркинсона: симптомы
Жесткие мышцы, медленные движения и дрожащие руки - типичные признаки болезни Паркинсона.
Ранние симптомы болезни Паркинсона
Признаки прогрессирующего заболевания головного мозга могут появиться за годы до появления основных симптомов. К таким ранним симптомам Паркинсона относятся:
- Расстройство поведения во сне в фазе быстрого сна: Обычно человек «парализован» во сне. При расстройстве поведения во сне в фазе быстрого сна выполняются некоторые из приснившихся движений (речь, смех, жесты и т. Д.). Это может быть опасно для человека и спящего партнера.
- Обоняние снижено или полностью отсутствует (гипосмия / аносмия).
- Боль в мышцах и суставах (дизестезия), часто в области плеч и рук.
- Руки меньше раскачиваются при ходьбе.
- Вставание, мытье, одевание, прием пищи и т. Д. Занимают больше времени, чем раньше.
- запор
- Зрительные расстройства (например, нарушение цветового зрения)
- Почерк кажется скудным и становится меньше, особенно в конце строки или страницы.
- депрессии
- Усталость, истощение
- скованность, чувство неуверенности, шаткость
- Пациент отказывается от своих увлечений и пренебрегает ими.
Многие из этих ранних симптомов Паркинсона очень неспецифичны. Таким образом, у них может быть много других причин (например, пожилой возраст). Из-за этого их часто не распознают как ранние признаки болезни Паркинсона.
-
Вождение с болезнью Паркинсона
Три вопроса для

Проф. мед. Майкл Т. Барб,
Специалист по неврологии -
1
Вы все еще можете водить машину с болезнью Паркинсона?
Проф. мед. Майкл Т. Барб
Этот вопрос очень часто задают пациенты с болезнью Паркинсона, и, к сожалению, на него не так просто ответить. По сути, это зависит от стадии заболевания и жалоб пациента.Если после первоначального диагноза у пациента есть лишь несколько ограничений и он хорошо поправился с помощью лекарств, ничто не говорит против вождения автомобиля. Если есть колебания в действии или соответствующие нарушения концентрации и памяти, я в принципе советую этого не делать.
-
2
Как узнать, могу ли я водить машину?
Проф. мед. Майкл Т. Барб
Интересно, что партнеры пострадавших, которые больше не чувствуют себя в безопасности как пассажиры, часто дают первые подсказки. Тогда я бы посоветовал вам взять уроки вождения. Вы получаете обратную связь от инструктора по вождению, который хорошо оценивает ситуацию. Конечно, пациенты также могут пройти официальный тест на пригодность к вождению - однако, если они не справятся, водительские права должны быть сданы.
-
3
Можете ли вы, как врач, запретить людям водить машину?
Проф. мед. Майкл Т. Барб
Нет, пациенты с болезнью Паркинсона обычно не могут заявить, что они не могут водить машину, например, у пациентов с эпилептическими припадками. Это всегда трудное решение для врача: с одной стороны, вы не хотите ограничивать независимость пациента, но с другой стороны, вы не хотите подвергать опасности кого-либо в движении. Я всегда активно обсуждаю это с пациентами - но в конечном итоге это основано на их добровольности.
-
Проф. мед. Майкл Т. Барб,
Специалист по неврологииСтарший врач неврологической клиники и поликлиники в Кельне, руководитель рабочей группы по двигательным расстройствам и глубокой стимуляции мозга, глава Кельнской сети Паркинсона.
Расстройство быстрого сна
Наиболее важным ранним признаком является нарушение поведения во сне в фазе быстрого сна: любой, кто демонстрирует эту форму нарушения сна, обычно имеет повышенный риск так называемых нейродегенеративных заболеваний. Это прогрессирующие заболевания, связанные с потерей нервных клеток. У большинства людей с расстройством поведения во время быстрого сна позже развивается болезнь Паркинсона. У других развивается определенная форма деменции (деменция с тельцами Леви).
Болезнь Паркинсона: основные симптомы
Симптомы болезни Паркинсона обычно развиваются незаметно. Родные и близкие часто замечают их раньше, чем сам пациент.
В большинстве случаев признаки болезни Паркинсона начинаются односторонне, то есть только на одной стороне тела. Позже они перекинулись и на другую сторону. Они также становятся все более выраженными по мере прогрессирования болезни.
Типичные симптомы Паркинсона:
- Замедленные движения (брадикинезия) вплоть до малоподвижного образа жизни (гипокинез) или неподвижности (акинезия)
- жесткие мышцы (окоченение)
- Мышечный тремор в покое (тремор Паркинсона)
- недостаточная устойчивость вертикальной позы (постуральная нестабильность)
Замедленные движения (брадикинезия): все движения тела неестественно медленные. Это означает, например, что люди с болезнью Паркинсона ходят заметно медленно и небольшими шагами. Со временем походка искажается, и пациенты наклоняются вперед. Это один из самых заметных симптомов. Пациенты с болезнью Паркинсона также могут медленно и с трудом садиться и вставать. Иногда пострадавшие внезапно блокируются в движениях - они как бы замирают. Врачи называют это «замерзанием».
Симптомы болезни Паркинсона также влияют на жесты и мимику: лицо все больше напоминает жесткую маску. Пострадавшие обычно говорят тихо и монотонно, что затрудняет их понимание. Часто у них также возникают проблемы с глотанием, например, когда они пьют или едят. Еще одним признаком болезни Паркинсона является нарушение мелкой моторики: например, больным трудно что-то написать, застегнуть пальто или почистить зубы.
Если движения тела особенно медленные или пациент частично полностью неподвижен, врачи говорят об акинезии (акинезии).
Жесткие мышцы (окоченение): болезнь Паркинсона не вызывает паралича, но сила мышц в значительной степени сохраняется. Однако мышцы постоянно напряжены даже в состоянии покоя. Это больно для пострадавших. Особенно болезненна область плеч и шеи.
Жесткость мышц может быть продемонстрирована так называемым феноменом передачи: если врач пытается пошевелить рукой пациента, этому препятствуют жесткие мышцы. Следовательно, руку можно двигать только немного и рывками. Такое ощущение, что в шарнире есть шестерня, которая позволяет двигаться только до следующей выемки, а затем защелкивается. Явление передачи обычно проверяется на локтевом суставе или запястье. Это типичный признак болезни Паркинсона, но может встречаться и при других заболеваниях.
Мышечный тремор в покое (тремор в покое): при болезни Паркинсона руки и ноги обычно начинают дрожать в состоянии покоя. Именно поэтому болезнь еще называют «параличом». Одна сторона тела обычно поражается сильнее, чем другая. Кроме того, рука обычно трясется сильнее, чем нога.
Тремор Паркинсона обычно возникает в покое. Это позволяет отличить болезнь Паркинсона от других заболеваний с тремором (тремором). Если, например, рука дрожит не в состоянии покоя, а как только вы хотите сделать определенное движение, врачи говорят о так называемом интенционном треморе. Причина - повреждение или нарушение мозжечка.
Между прочим: у большинства людей, которые трепещут, нет ни болезни Паркинсона, ни других известных неврологических заболеваний. Причина этого «эссенциального тремора» неизвестна.
Недостаточная устойчивость вертикальной позы: Подсознательно каждый человек корректирует свою осанку в любой момент при ходьбе и стоянии. Все это контролируется так называемыми установочными и удерживающими рефлексами. Рефлексы - это автоматические движения, которые запускаются определенными стимулами. Это бессознательные непроизвольные движения или напряжение мышц. Удерживающие и регулирующие рефлексы человека ответственны за то, что человек может автоматически уравновешивать тело даже при движении и не падает.
При болезни Паркинсона обычно нарушаются установочные и удерживающие рефлексы. Таким образом, у больных возникают проблемы с устойчивым удержанием вертикального положения. Это называется постуральной нестабильностью. Это причина того, почему пациенты с болезнью Паркинсона больше не могут легко «поглощать» внезапные, непредвиденные движения, например, при спотыкании или внезапном порыве ветра. Поэтому они небезопасны при ходьбе и легко падают.
Видимые симптомы болезни Паркинсона
Болезнь Паркинсона: сопутствующие симптомы
Основные симптомы Паркинсона иногда сопровождаются другими симптомами:
Пациенты с болезнью Паркинсона чаще страдают депрессией, чем здоровые люди и люди с другими хроническими заболеваниями. Иногда депрессия не развивается, пока вы не заболеете болезнью Паркинсона. У других пациентов он предшествует двигательным симптомам (замедленность движений и т. Д.).
Кроме того, болезнь Паркинсона может снизить интеллектуальную работоспособность и развить деменцию (см. Ниже). Пострадавшие имеют все большие трудности с мышлением. Однако не следует забывать, что большинство здоровых людей в старости думают медленнее и им труднее запоминать. Так что это не обязательно должно быть признаком болезни Паркинсона.
У многих пациентов с болезнью Паркинсона кожа лица выделяет чрезмерное количество кожного сала. Это делает его жирным и блестящим. Врачи говорят о так называемом «мазевом лице»: лицо пациента выглядит так, как если бы пострадавший нанес толстый слой мази или крема для лица.
Возможные симптомы Паркинсона также связаны с заболеваниями мочевого пузыря: многие пациенты больше не могут контролировать свой мочевой пузырь должным образом. Может случиться так, что моча отходит непроизвольно (недержание мочи) и пациенты мочатся ночью (энурез). Но возможно и обратное: у некоторых пациентов возникают проблемы с мочеиспусканием (задержка мочи).
При болезни Паркинсона кишечник часто бывает вялым, поэтому развиваются запоры. Такой запор также может быть ранним признаком болезни Паркинсона.
У мужчин иногда возникают проблемы с потенцией (эректильная дисфункция). Эта импотенция может быть результатом как самого заболевания, так и лекарств от болезни Паркинсона.
Все упомянутые сопутствующие симптомы также могут быть вызваны другими заболеваниями, а не только болезнью Паркинсона.
Деменция Паркинсона
Пациенты с болезнью Паркинсона более подвержены деменции, чем население в целом: примерно у трети пациентов также развивается деменция в ходе болезни. Согласно некоторым исследованиям, риск деменции при болезни Паркинсона еще выше (до 80 процентов).
Симптомы деменции Паркинсона в первую очередь включают нарушение бдительности и замедленное мышление. Это важное отличие от болезни Альцгеймера - наиболее распространенной формы деменции. Пациенты с болезнью Альцгеймера в основном страдают нарушениями памяти. Однако при деменции Паркинсона они возникают только на более поздних стадиях болезни.
Подробнее об этом читайте в статье Деменция при болезни Паркинсона.
Болезнь Паркинсона: причины
Врачи также называют болезнь Паркинсона первичной или идиопатическим синдромом Паркинсона (IPS). «Идиопатический» означает, что не может быть обнаружено никакой реальной причины заболевания. Эта «настоящая» болезнь Паркинсона составляет около 75 процентов всех синдромов Паркинсона. Он находится в центре внимания этого текста. Следует различать редкие генетические формы болезни Паркинсона, «вторичный синдром Паркинсона» и «синдром атипичного Паркинсона». Их краткое описание приводится ниже.
Идиопатическая болезнь Паркинсона: дефицит дофамина
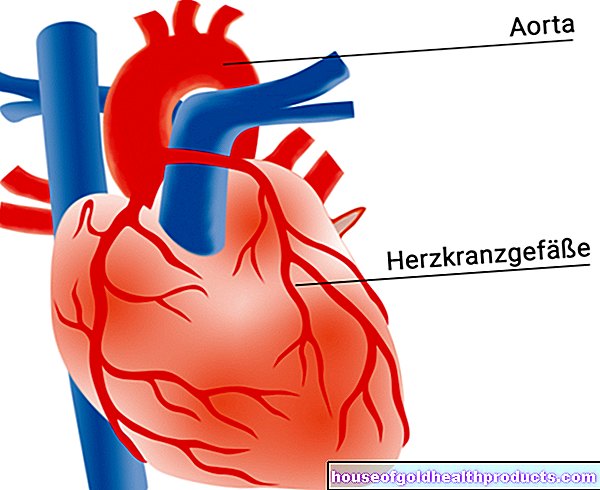
Болезнь Паркинсона начинается в определенной области мозга, так называемом «черном веществе» (черной субстанции) в среднем мозге. Эта область мозга содержит много железа и пигмента меланина. Оба они придают «черной субстанции» поразительно темный цвет (по сравнению с иначе светлой тканью мозга).
«Черная субстанция» содержит особые нервные клетки, вырабатывающие нейромедиатор дофамин. Дофамин очень важен для контроля движений. При идиопатической болезни Паркинсона погибает все больше и больше нервных клеток, продуцирующих дофамин. Вы не знаете почему.
В результате прогрессирующей гибели клеток уровень дофамина в головном мозге продолжает снижаться - развивается дефицит дофамина. Организм может компенсировать это в течение длительного времени: только когда около 60 процентов нервных клеток, продуцирующих дофамин, умирают, дефицит дофамина становится заметным: пациент двигается все медленнее (брадикинезия) или иногда перестает двигаться вообще ( акинезия).
Однако дефицит дофамина сам по себе не является единственной причиной болезни Паркинсона: он также нарушает хрупкий баланс нейромедиаторов: из-за того, что дофамина становится все меньше и меньше, количество связующего вещества ацетилхолина, например, увеличивается в относительном выражении. Специалисты предполагают, что это причина тремора (тремора) и ригидности мышц (ригидности) при болезни Паркинсона.
Это случается с болезнью Паркинсона
Дисбаланс нейротрансмиттеров при болезни Паркинсона также может быть причиной того, что многие пациенты впадают в депрессию. Потому что мы знаем, что при депрессии обычно нарушается баланс нейромедиаторов. Связь между болезнью Паркинсона и депрессией окончательно не выяснена.
Причины болезни Паркинсона: много предположений, мало доказательств
До сих пор неясно, почему нервные клетки в «черной субстанции» умирают при болезни Паркинсона. Исследования показывают, что в развитии болезни Паркинсона участвуют несколько факторов.
Например, ученые обнаружили, что нервные клетки у пациентов с болезнью Паркинсона не могут адекватно удалять вредные вещества. Вещества, повреждающие клетки, представляют собой, например, так называемые «свободные радикалы». Это агрессивные кислородные соединения, которые возникают в клетке при различных метаболических процессах.
Нервные клетки у пациентов с болезнью Паркинсона могут быть не в состоянии расщеплять эти опасные вещества до того, как они нанесут ущерб. Или способность клеток к детоксикации нормальная, но при болезни Паркинсона вырабатывается чрезмерное количество «свободных радикалов». В обоих случаях вещества, повреждающие клетки, могут накапливаться в нервных клетках и вызывать их гибель.
Существуют также другие возможные причины болезни Паркинсона, которые в настоящее время обсуждаются и исследуются.
Генетические формы болезни Паркинсона
Когда член семьи болеет болезнью Паркинсона, это беспокоит многих родственников. Вам интересно, является ли болезнь Паркинсона наследственной. Однако в подавляющем большинстве случаев болезнь Паркинсона является описанной выше идиопатической болезнью Паркинсона. Эксперты считают, что при этой спорадической форме заболевания наследование не является проблемой.
Иная ситуация с так называемыми моногенетическими формами болезни Паркинсона: каждая из них вызвана изменением (мутацией) определенного гена. Эти генные мутации могут передаваться потомству. Таким образом, моногенные формы болезни Паркинсона передаются по наследству. Их часто называют семейным синдромом Паркинсона. К счастью, они редки.
Вторичный синдром Паркинсона
В отличие от идиопатической болезни Паркинсона, симптоматический (или вторичный) синдром Паркинсона имеет четко идентифицируемые причины. Это включает:
- Лекарства: ингибиторы дофамина (антагонисты дофамина), такие как нейролептики (для лечения психозов) или метоклопрамид (от тошноты и рвоты), литий (от депрессии), вальпроевая кислота (от судорог), антагонисты кальция (от высокого кровяного давления).
- другие заболевания, такие как опухоли головного мозга, воспаление головного мозга (например, в результате СПИДа), недостаточная активность паращитовидных желез (гипопаратиреоз) или болезнь Вильсона (болезнь накопления меди)
- Отравление, например, марганцем или оксидом углерода
- Травмы головного мозга
Атипичный синдром Паркинсона
Атипичный синдром Паркинсона возникает на фоне различных нейродегенеративных заболеваний. Это заболевания, при которых нервные клетки в головном мозге постепенно умирают. В отличие от идиопатического синдрома Паркинсона, эта гибель клеток влияет не только на «черную субстанцию», но и на другие области мозга. Следовательно, при атипичном синдроме Паркинсона помимо симптомов, подобных паркинсонизму, есть и другие симптомы.
Нейродегенеративные заболевания, которые могут вызвать атипичный синдром Паркинсона, включают, например:
- Деменция с тельцами Леви
- Множественная системная атрофия (МСА)
- Прогрессирующий надъядерный паралич (ПСП)
- Кортикобазальная дегенерация
Такие заболевания имеют значительно худший прогноз, чем «настоящий» (идиопатический) синдром Паркинсона.
Кстати: препарат «L-допа», который очень хорошо действует при идиопатической болезни Паркинсона, почти или совсем не помогает при атипичной болезни Паркинсона.
Болезнь Паркинсона: лечение
Лечение болезни Паркинсона подбирается индивидуально для каждого пациента. Потому что симптомы болезни могут варьироваться от человека к человеку и прогрессировать с разной скоростью.
В большинстве случаев болезнь Паркинсона лечится с помощью лекарств, хотя легкие симптомы иногда вначале не требуют лечения. Какие активные ингредиенты используются, в основном зависит от возраста пациента. Иногда может оказаться полезным и нейрохирургическое вмешательство - так называемая глубокая стимуляция мозга (DBS).
В дополнение к лекарствам и, при необходимости, хирургическим вмешательствам, индивидуальное лечение болезни Паркинсона может также включать другие компоненты. К ним относятся, например, физиотерапия, логопедия и трудотерапия. В любом случае есть смысл лечиться в специальной клинике Паркинсона.
Терапия Паркинсона: лекарства
Есть несколько препаратов для лечения болезни Паркинсона. Они помогают против таких недугов, как замедленные движения, жесткие мышцы и тремор. Однако они не могут предотвратить отмирание нервных клеток и тем самым предотвратить прогрессирование болезни.
Типичные симптомы Паркинсона вызваны нехваткой дофамина в головном мозге. Их можно облегчить, либо добавляя вещество-мессенджер в качестве лекарственного средства (например, в форме L-допа), либо предотвращая распад существующего дофамина (ингибиторы MAO-B, ингибиторы COMT). Оба механизма компенсируют дефицит дофамина. Таким образом вы в значительной степени устраняете типичные симптомы болезни Паркинсона.
L-допа (леводопа)
Нет смысла вводить недостающий дофамин пациентам с болезнью Паркинсона напрямую в виде инъекции или таблетки: вещество-мессенджер действительно транспортируется в мозг через кровоток. Однако он не может преодолевать защитный гематоэнцефалический барьер, то есть не может напрямую попасть в нервную ткань. Предшественник дофамина способен на это: поэтому эта L-допа (леводопа) подходит для лечения болезни Паркинсона. Попадая в мозг, он превращается в дофамин под действием фермента допа декарбоксилазы. Затем это может проявиться в мозге и облегчить симптомы Паркинсона, такие как жесткость мышц (ригидность).
L-Dopa очень эффективен и имеет мало побочных эффектов. Чаще всего его принимают в форме таблеток, капсул или капель. Врачи в первую очередь назначают его пациентам старше 70 лет. Однако у более молодых пациентов L-допа используется очень осторожно. Причина в том, что лечение L-допа может вызвать двигательные нарушения (дискинезию) и колебания эффекта (колебания эффекта) через несколько лет (см. Побочные эффекты).
L-допа всегда сочетается с другим активным ингредиентом, так называемым ингибитором допа-декарбоксилазы (таким как бенсеразид или карбидопа). Это предотвращает превращение L-допа в дофамин в крови, то есть до того, как он достигнет мозга. Ингибитор допа-декарбоксилазы не может проникнуть даже через гематоэнцефалический барьер. Таким образом, в мозге L-допа может без проблем превращаться в дофамин.
Каждый пациент с болезнью Паркинсона по-разному реагирует на L-допа. Поэтому дозировка определяется индивидуально: терапию начинают с низкой дозы, а затем постепенно увеличивают до достижения желаемого эффекта.
Обычно L-Dopa следует принимать несколько раз в день. По возможности, это всегда должно происходить в одно и то же время. Таким образом можно предотвратить эффект колебаний.
Также важно, чтобы L-допа принимался по крайней мере за час до или после богатой белком еды. Продукты, богатые белком, мешают всасыванию активного ингредиента в кровь.
Побочные эффекты: терапия Паркинсона L-допа обычно очень хорошо переносится, особенно в низких дозах. Однако тошнота может возникнуть особенно в начале терапии. Однако это можно исправить с помощью активного ингредиента домперидона. Однако нельзя использовать другие лекарства от тошноты, такие как метоклопрамид: они также проникают через гематоэнцефалический барьер и могут нейтрализовать действие L-допа.
Другие возможные побочные эффекты L-Dopa - плохой аппетит, головокружение, повышенная активность и депрессия. В частности, пожилые люди иногда испытывают галлюцинации, спутанность сознания и обсессивно-компульсивное поведение при лечении L-допой. Последнее проявляется, например, как пристрастие к азартным играм или покупкам, как постоянное желание поесть или заняться сексом, или как навязчивое упорядочивание предметов.
Двигательные расстройства (дискинезия) также являются возможными побочными эффектами L-Dopa: пораженные пациенты непроизвольно подергиваются или делают резкие движения, которые они не могут предотвратить. Чем дольше человек лечится L-допа, тем более частыми и тяжелыми становятся такие двигательные расстройства.
Длительное лечение L-допа также может вызвать колебания эффекта препарата (колебания эффекта): иногда пациенты с болезнью Паркинсона больше не могут двигаться («фаза выключения»), затем снова полностью нормальны («фаза включения». ).
В таких случаях может помочь изменение режима дозирования L-допа. Или пациент может перейти на препарат L-Dopa замедленного действия: таблетки замедленного действия высвобождают активный ингредиент медленнее и в течение более длительного периода времени, чем «нормальные» (не замедленные) препараты L-Dopa. Затем лечение обычно снова работает более равномерно.
В случае колебаний эффектов L-допы (фазы включения-выключения) и / или двигательных нарушений врач может также дать пациенту переносную помпу для лекарственных препаратов: она автоматически направляет леводопу через тонкий зонд непосредственно в двенадцатиперстную кишку, где он всасывается в кровь (дуоденальный зонд). Таким образом, активный ингредиент вводится пациенту непрерывно. Таким образом можно достичь очень равномерного уровня активности в крови. Это снижает риск колебаний эффективности и двигательных нарушений. Однако дуоденальный зонд также несет риск, например, перитонита. Поэтому его используют только в отдельных случаях и опытные врачи.
Альтернативой помповой терапии является «глубокая стимуляция мозга» (см. Ниже).
Агонисты дофамина
У пациентов моложе 70 лет терапию Паркинсона обычно начинают с так называемых агонистов дофамина. Только позже происходит переход на более эффективную L-Dopa. Это задерживает начало двигательных расстройств, например, вызванных длительным приемом L-допы.
Агонисты дофамина химически подобны допамину, являющемуся посредником. Они легко преодолевают гематоэнцефалический барьер и прикрепляются к тем же участкам связывания (рецепторам) нервных клеток, что и дофамин. Вот почему они также имеют похожий эффект.
Большинство агонистов дофамина, используемых в терапии Паркинсона, принимаются перорально (например, в таблетках). Это относится, например, к прамипексолу, пирибедилу и ропиниролу. Другие представители вводятся в виде пластыря с активным ингредиентом (ротиготин) или в виде шприца или инфузии (апоморфин).
Побочные эффекты: агонисты дофамина переносятся хуже, чем L-допа. Например, они вызывают задержку воды в тканях (отек), запор, сонливость, головокружение и тошноту. Как и L-допа, агонисты дофамина могут вызывать галлюцинации, спутанность сознания и компульсивное поведение, особенно у пожилых людей.
При длительном применении агонисты дофамина также могут вызывать колебания действия (колебания с фазами включения-выключения). Но это происходит гораздо реже, чем с L-Dopa. Колеблющийся эффект можно компенсировать, регулируя дозировку агонистов дофамина или переводя пациента с таблеток на пластырь с активным ингредиентом (с ротиготином).
Есть и другая возможность в случае колебаний эффекта: в дополнение к таблеткам пациенту вводят инъекции апоморфина в подкожно-жировую клетчатку (подкожно). Апоморфин может быстро облегчить симптомы Паркинсона, которые остаются неприятными, несмотря на прием таблеток. Возможные побочные эффекты: тошнота, рвота, усиление или вновь возникающие двигательные нарушения (дискинезия), головокружение, галлюцинации и т. Д.
Если все эти попытки не могут компенсировать колебания в эффекте, пациенту можно дать переносную помпу для приема лекарств (помпу для апоморфина). Он высвобождает активный ингредиент непрерывно (обычно от 12 до 18 часов) в подкожно-жировую клетчатку на животе или бедре через тонкую трубку и тонкую иглу.
До сих пор отсутствуют всесторонние исследования этой помповой терапии апоморфином. Исследования показывают, что он может значительно сократить ежедневные фазы выключения (во время которых пациент почти не может двигаться). Двигательные расстройства (дискинезия) также могут уменьшаться с помощью апоморфиновой помпы.
Возможные побочные эффекты - это, прежде всего, кожные реакции в месте введения иглы, некоторые из которых могут быть серьезными (болезненное покраснение, образование стручков, отмирание тканей = некроз и т. Д.). Некоторые пациенты также жалуются на тошноту, рвоту, проблемы с кровообращением и галлюцинации.
Ингибиторы МАО-В
Ингибиторы MAO-B (например, селегилин) блокируют фермент моноаминоксидазу-B (MAO-B), который обычно расщепляет дофамин. Таким образом можно повысить уровень дофамина в головном мозге пациентов с болезнью Паркинсона.
Ингибиторы МАО-В менее эффективны, чем леводопа или агонисты дофамина. В качестве единственной терапии Паркинсона они подходят только для легких симптомов (обычно на ранних стадиях болезни). Однако их можно комбинировать с другими лекарствами от болезни Паркинсона (такими как L-Dopa).
Побочные эффекты: Считается, что ингибиторы МАО хорошо переносятся. У них есть только легкие и обратимые побочные эффекты. К ним относятся нарушения сна, потому что лекарства усиливают драйв. Поэтому принимать ингибиторы МАО-В следует в начале дня. Тогда сон вечером не нарушается.
Ингибиторы СОМТ
Ингибиторы СОМТ (например, энтакапон) назначают вместе с L-допа. Они также блокируют фермент, расщепляющий дофамин (так называемая катехол-O-метилтрансфераза = COMT). Таким образом, ингибиторы СОМТ продлевают действие дофамина.
Активные ингредиенты в основном назначаются для уменьшения колебаний эффектов терапии L-допа. Так что это лекарства от поздних стадий болезни Паркинсона.
Побочные эффекты: Ингибиторы СОМТ обычно хорошо переносятся. Возможные нежелательные эффекты включают диарею, тошноту и рвоту.
Антихолинергические средства
Так называемые холинолитики были первыми лекарствами, которые использовались для терапии Паркинсона. Сегодня их назначают не так часто.
Из-за дефицита дофамина при болезни Паркинсона другие нейротрансмиттеры - в относительном выражении - присутствуют в избытке. Это относится, например, к ацетилхолину. Это вызывает, среди прочего, типичный тремор (тремор) у пациента. Его можно облегчить с помощью холинолитиков, потому что они блокируют действие ацетилхолина на мозг.
Побочные эффекты: антихолинергические препараты могут иметь множество побочных эффектов. К ним относятся, например, сухость во рту, сухость глаз, снижение (редко повышенное) потоотделение, нарушения опорожнения мочевого пузыря, запоры, учащенное сердцебиение, светочувствительность глаз, нарушения мышления и спутанность сознания.
В частности, пожилые люди часто плохо переносят холинолитики. Поэтому препаратам отдают предпочтение более молодым пациентам.
Антагонисты NMDA
Как и ацетилхолин, глутамат нейротрансмиттера также доступен в относительном избытке при болезни Паркинсона из-за недостатка дофамина. Против этого помогают так называемые антагонисты NMDA (амантадин, будипин). Они блокируют определенные точки стыковки глутамата в головном мозге и, таким образом, снижают его эффект.
Антагонисты NMDA используются на ранних стадиях первичной болезни Паркинсона.
Побочные эффекты: Возможные нежелательные эффекты амантадина включают, например, беспокойство, тошноту, потерю аппетита, сухость во рту, сетчатые изменения кожи (livedo reticularis), а также спутанность сознания и психоз (особенно у пожилых пациентов). Будипин может вызывать опасные сердечные аритмии.
Глубокая стимуляция мозга (DBS)
Глубокая стимуляция головного мозга (DBS) - это хирургическая процедура, выполняемая на головном мозге. Иногда это делается при идиопатической болезни Паркинсона. Английское название - «Deep Brain Stimulation» (DBS).
При глубокой стимуляции мозга небольшие электроды вставляются в определенные области мозга во время операции. Предполагается, что они положительно влияют на патологическую активность нервных клеток (стимулируют или подавляют). Это означает, что глубокая стимуляция мозга работает аналогично кардиостимулятору. Поэтому его иногда называют «кардиостимулятором мозга» (даже если этот термин не совсем правильный).
Стимуляция глубокого мозга может рассматриваться, если:
- Колебания эффекта (колебания) и непроизвольные движения (дискинезия) не могут быть устранены с помощью лекарств или
- дрожь (тремор) нельзя устранить с помощью лекарств.
Кроме того, пациент должен соответствовать другим требованиям. Например, у него не должно быть ранних симптомов деменции. Его общее физическое состояние должно быть хорошим. Кроме того, симптомы Паркинсона (за исключением тремора) должны реагировать на L-допа.
Опыт показал, что процедура может эффективно облегчить симптомы у многих пациентов и значительно улучшить качество жизни. Эффект также сохраняется в долгосрочной перспективе. Но это не значит, что глубокая стимуляция мозга может вылечить болезнь Паркинсона - болезнь будет прогрессировать после процедуры.
Кстати: изначально глубокая стимуляция мозга проводилась в основном у пациентов с запущенной болезнью Паркинсона. Между тем, однако, исследования показали, что он также подходит для пациентов в возрасте до 60 лет, у которых терапия L-допа только недавно показала колебания в эффективности и вызывает двигательные нарушения.
Как работает процедура?
Глубокая стимуляция головного мозга проводится в специализированных клиниках (центрах DBS). Перед операцией к голове пациента прочно прикрепляют прочный металлический каркас. Во время самой операции рама прочно прикреплена к операционному столу. Таким образом, голова все время остается в одном и том же положении. Это необходимо для максимально точной работы с медицинскими инструментами («стереотаксическая хирургия головного мозга»).
Теперь выполняется компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) головы, зажатой в рамке. Компьютер можно использовать для точного расчета, под каким углом и на какой глубине в головном мозге электроды должны быть вставлены, чтобы кончики электродов находились в нужном месте. «Правильное место» - это обычно крошечный участок мозга, называемый субталамическим ядром (NST).
Следующим шагом является сама операция: нейрохирург с помощью специального сверла просверливает два небольших отверстия в верхней части черепа, чтобы вставить крошечные электроды. Звучит жестоко, но пациенту не больно. Он не спит на протяжении всей операции. Это необходимо для того, чтобы хирург мог проверить правильность размещения электродов во время теста.
На следующий день под общим наркозом имплантируют импульсный генератор под кожу ключицы или в верхнюю часть живота. Он связан с электродами в головном мозге небольшими кабелями. Кабели проходят под кожей.
Генератор импульсов непрерывно подает ток на электроды. В зависимости от частоты тока области на концах электродов стимулируются или подавляются. Это немедленно снимает основные двигательные симптомы болезни Паркинсона, то есть замедление движений, ригидность мышц и тремор. При необходимости частоту сети можно перенастроить с помощью пульта дистанционного управления.
Если вмешательство не дает желаемого эффекта, электроды можно снова удалить или выключить генератор импульсов.
Возможные осложнения и побочные эффекты
В целом, глубокая стимуляция мозга более эффективна у пациентов в возрасте до 50 лет и с меньшей вероятностью вызывает осложнения, чем у пожилых людей.
Самым важным осложнением, которое может возникнуть в результате самой операции на головном мозге, является черепно-мозговое кровотечение (внутричерепное кровотечение). Кроме того, вставка генератора импульсов и кабелей может вызвать инфекцию. Затем обычно необходимо временно удалить систему и лечить пациента антибиотиками.
Практически у каждого пациента после процедуры будут возникать временные побочные эффекты, если система все еще настраивается. Это может быть, например, парестезия (парестезия). Однако они часто возникают только сразу после включения генератора импульсов, а затем снова исчезают.
Другими, в основном временными эффектами, являются, например, спутанность сознания, повышенное влечение, упадок настроения и апатия. Иногда также возникают так называемые нарушения контроля над импульсами. Это включает, например, повышенное сексуальное желание (гиперсексуальность). У некоторых пациентов глубокая стимуляция мозга также вызывает легкие нарушения речи, нарушение координации движений (атаксию), головокружение и неустойчивую походку и стойку.
Дальнейшие методы лечения
Различные концепции лечения также могут помочь пациентам с болезнью Паркинсона как можно дольше сохранять подвижность, способность говорить и независимость в повседневной жизни. Основные процедуры:
Физиотерапия: физиотерапия включает в себя множество различных техник. Например, пациенты могут тренировать равновесие и безопасность во время ходьбы с помощью подходящих упражнений. Также полезны силовые упражнения и упражнения на растяжку. Также можно специально тренировать скорость и ритм движений.
Логопедия: у многих пациентов в ходе болезни Паркинсона развивается нарушение речи. Например, вы говорите удивительно монотонно и очень тихо или часто сталкиваетесь с блокировками во время разговора. Здесь может помочь логопедия.
Трудотерапия: цель трудотерапии состоит в том, чтобы пациенты с болезнью Паркинсона оставались независимыми в своей личной среде как можно дольше. Для этого, например, вы адаптируете жилое пространство, чтобы пациент мог лучше ориентироваться. Он также удаляет камни преткновения, такие как ковры. Эрготерапевт также работает с пострадавшими, чтобы разработать стратегии того, как лучше справляться с этой болезнью в повседневной жизни. Например, он показывает пациенту, как пользоваться вспомогательными средствами, такими как приспособления для снятия чулок или приспособления для застегивания пуговиц. Кроме того, терапевт консультирует родственников о том, как они могут оказать значимую поддержку пациенту с болезнью Паркинсона в повседневной жизни.
Лечение сопутствующих заболеваний
Болезнь Паркинсона часто поражает пожилых людей. Они обычно также страдают от других заболеваний, таких как высокое кровяное давление, сердечная недостаточность (сердечная недостаточность), повышенный уровень липидов в крови или диабет. Эти сопутствующие заболевания также необходимо лечить должным образом. Это положительно сказывается на качестве и продолжительности жизни пациента.
Терапия Паркинсона: что вы можете сделать самостоятельно?
Как и в случае с большинством хронических жалоб и заболеваний, к болезни Паркинсона применимо следующее: пострадавшие должны активно бороться со своей болезнью и узнавать о причинах и вариантах лечения. Потому что во многих случаях пациента особенно беспокоит страх неуверенности. Чем больше узнают о болезни, тем скорее исчезает чувство бессилия перед прогрессирующей болезнью Паркинсона.
К сожалению, в настоящее время болезнь неизлечима. Однако при правильном лечении многие пациенты могут вести в основном нормальный образ жизни.
Прочтите, что вы можете внести в эффективную терапию:
«Откровенно говорите о своей болезни. Многим людям с болезнью Паркинсона изначально очень трудно принять болезнь и открыто бороться с ней. Вместо этого они пытаются скрыть симптомы. Но это подвергает вас ненужному давлению. Открытый разговор о своем состоянии с друзьями, семьей и коллегами по работе снимет с ваших плеч огромную ношу.
«Узнай о болезни. Чем больше вы знаете о болезни Паркинсона, тем менее страшной она может вам казаться. Как родственник пациента с болезнью Паркинсона, вы также должны узнать об этом заболевании. Таким образом вы сможете эффективно и разумно поддержать своих близких.
»Присоединяйтесь к группе поддержки Паркинсона. Те, кто может регулярно обмениваться идеями с другими больными, часто лучше справляются с болезнью.
"Оставаться в форме. Вы можете поддерживать хорошее общее состояние и оставаться физически активным. Достаточно регулярных упражнений (например, прогулок) и легких видов спорта на выносливость. Родственники могут поддержать пациента в этом.
»Используйте небольшие вспомогательные средства в повседневной жизни. Многие симптомы Паркинсона затрудняют повседневную жизнь. Это включает в себя так называемое «замораживание» - заинтересованное лицо больше не может двигаться. Здесь помогают зрительные стимулы на полу, например, приклеенные следы или генераторы акустических ритмов («Влево, два, три, четыре»). Важно для людей: нет смысла торопить или тянуть пациента. Это имеет тенденцию продлевать эпизод «замораживания».
" Здоровое питание. Люди с болезнью Паркинсона часто едят и пьют слишком мало, потому что они неуклюжи и медлительны. Некоторые также хотят по возможности избегать утомительного посещения туалета. Однако для здорового общего состояния очень важно пить достаточно жидкости (около двух литров в день) и соблюдать сбалансированную диету.
Болезнь Паркинсона: специализированные клиники
По возможности, люди с синдромом Паркинсона должны лечиться в специализированной клинике. Врачи и другие сотрудники специализируются на этой болезни.
В настоящее время в Германии существует множество клиник, которые предлагают неотложное лечение и / или реабилитацию пациентов с болезнью Паркинсона. Некоторые из них имеют сертификат Немецкой ассоциации болезни Паркинсона (dPV). Он присуждается больницам и реабилитационным центрам, которые имеют специальные диагностические и терапевтические предложения для людей с болезнью Паркинсона и родственными заболеваниями. В специальных клиниках выдается сертификат dPV сроком на три года. По запросу соответствующего учреждения он может быть продлен еще на три года после повторного экзамена.
Избранный список специальных клиник для пациентов с болезнью Паркинсона можно найти в статье Паркинсон - Клиника.
Болезнь Паркинсона: обследования и диагностика
Если вы подозреваете, что у вас или у вашего родственника болезнь Паркинсона, желательно обратиться к квалифицированному врачу. Специалист по заболеваниям нервной системы - невролог. Лучше всего обратиться к неврологу, который специализируется на диагностике и лечении болезни Паркинсона. Некоторые неврологические клиники также имеют свои собственные часы приема или поликлиники для пациентов с болезнью Паркинсона.
Разговор врача с пациентом
Во время первого визита невролог изучит историю болезни (анамнез) в разговоре с вами или членом семьи. Этот разговор чрезвычайно важен для диагностики болезни Паркинсона: если пациент подробно описывает свои симптомы, врач может оценить, действительно ли это может быть болезнь Паркинсона. Возможные вопросы врача включают, например:
- Примерно с каких пор существует тремор (тремор) рук / ног?
- У вас есть ощущение, что ваши мышцы постоянно напряжены?
- У вас болит, например, в области плеча или шеи?
- Вам сложно сохранять равновесие при ходьбе?
- Вам все труднее становится мелкая моторика (например, застегивать рубашку, писать)?
- У вас проблемы со сном?
- Вы заметили, что у вас ухудшилось обоняние?
- Была ли у родственников диагностирована болезнь Паркинсона?
- Вы принимаете лекарства, например, из-за проблем с психическим здоровьем? (Нейролептики, «антагонисты дофамина», такие как метоклопрамид)
Физикальное и неврологическое обследование
В дополнение к анамнезу следует физическое и неврологическое обследование. Врач обычно проверяет функцию нервной системы: например, он проверяет рефлексы пациента, чувствительность кожи и подвижность мышц и суставов. Особое внимание он уделяет основным симптомам болезни Паркинсона:
Замедленные движения (брадикинезия) очень характерны для болезни Паркинсона. Врач узнает вас, наблюдая за вашей походкой, жестами и мимикой. Он может попросить вас пройти несколько метров в экзаменационной комнате. Он также может оценить, «шатаетесь ли вы на ногах» (постуральная нестабильность).
Чтобы определить, стали ли ваши мышцы заметно жесткими (ригидностью), врач проверит, можно ли двигать вашими суставами плавно. При болезни Паркинсона напряжение мышц значительно увеличивается, поэтому мышцы оказывают сопротивление, когда врач пытается пошевелить суставом (например, локтем). Это явление также известно как явление зубчатого колеса (см. Выше: «Болезнь Паркинсона: симптомы»).
Во время медицинского осмотра врач определит, есть ли у вас тремор в состоянии покоя (тремор покоя). При диагностике болезни Паркинсона важно различать тремор в состоянии покоя (как при болезни Паркинсона) и другие типы тремора. Это включает, например, так называемый интенционный тремор: если мозжечок поврежден, рука начинает дрожать, как только человек пытается выполнить с ним определенное движение. С другой стороны, в покое рука не дрожит.
Тест Паркинсона (L-допа-тест)
Чтобы помочь диагностировать болезнь Паркинсона, иногда проводят так называемый L-допа-тест. Пациенты получают прекурсор дофамина L-Dopa (леводопа) однократно. Это препарат, который является стандартной терапией болезни Паркинсона. У некоторых пациентов двигательные нарушения и ригидность мышц улучшаются вскоре после приема пищи (примерно через полчаса). Тогда есть, вероятно, идиопатический синдром Паркинсона (внимание: тремор покоя не всегда можно снять с помощью леводопы).
L-допа-тест имеет ограниченное применение при диагностике болезни Паркинсона. Потому что у некоторых людей есть болезнь Паркинсона, но они не отвечают на тест. Тогда результат будет ложноотрицательным. И наоборот, тест на L-допа также может быть положительным при других заболеваниях, кроме болезни Паркинсона. Это касается, например, некоторых (но не всех) пациентов с так называемой мультисистемной атрофией. При этом прогрессирующем заболевании нервные клетки погибают в разных областях мозга. Это может вызвать атипичный синдром Паркинсона.
Из-за этих проблем L-допа-тест обычно не рекомендуется при диагностике Паркинсона.Другой причиной этого является то, что он может иметь побочные эффекты, такие как тошнота и рвота. Чтобы предотвратить это, пациентам перед тестом обычно назначают противорвотное средство домперидон.
Тест L-допа также может помочь спланировать терапию болезни Паркинсона: если болезнь Паркинсона обнаружена, тест можно использовать для проверки того, насколько хорошо пациент реагирует на L-допа. Но и здесь не стоит ожидать однозначного результата тестирования. Некоторые пациенты не реагируют на тест (отрицательный результат), но их все же можно лечить с помощью L-Dopa позже.
Кстати: вместо теста L-допа иногда делают тест на апоморфин для диагностики болезни Паркинсона. Здесь проверяется, улучшаются ли двигательные нарушения после инъекции апоморфина. Если так, это говорит об идиопатическом синдроме Паркинона. Здесь применимо то же самое, что и с тестом на L-допа: тест не является положительным для всех пациентов с болезнью Паркинсона. Кроме того, могут возникнуть такие побочные эффекты, как тошнота, рвота или сонливость.
Процедуры визуализации
С помощью компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) можно визуализировать мозг пациента. Это может помочь исключить другие возможные причины предполагаемых симптомов Паркинсона, такие как опухоль головного мозга. Таким образом, визуализация мозга помогает отличить идиопатическую болезнь Паркинсона от вторичной болезни Паркинсона или других нейродегенеративных заболеваний (например, атипичной болезни Паркинсона).
Для этого также могут проводиться специальные обследования. Это включает, например, ОФЭКТ (однофотонную эмиссионную компьютерную томографию), обследование ядерной медицины: пациенту сначала вводят радиоактивное вещество. Это можно использовать для отображения тех нервных окончаний в головном мозге, которые регрессируют при болезни Паркинсона (DAT-SPECT). Это может предоставить информацию в неясных случаях.
Если диагноз Паркинсона неясен, врач иногда назначает специальный вариант позитронно-эмиссионной томографии (ПЭТ): ФДГ-ПЭТ. Аббревиатура FDG означает фтордезоксиглюкозу. Это простой сахар с радиоактивной меткой. Его дают пациенту до того, как мозг будет сфотографирован с помощью ПЭТ. Прежде всего, это обследование может помочь прояснить атипичный синдром Паркинсона. Однако официально расследование для этого не санкционировано. Поэтому он используется только в обоснованных индивидуальных случаях («использование не по назначению»).
Ультразвуковое исследование головного мозга (транскраниальная сонография, TCS) менее сложное и менее затратное, чем эти специальные исследования. Это помогает распознать идиопатический синдром Паркинсона на ранних стадиях и дифференцировать его от других заболеваний (таких как синдромы атипичного Паркинсона). Однако врач должен иметь большой опыт проведения этого обследования. В противном случае он не сможет правильно интерпретировать результат теста.
Как в конечном итоге ставится диагноз Паркинсона?
Однозначный диагноз болезни Паркинсона по-прежнему часто бывает затруднен. Одна из причин этого заключается в том, что существует множество различных состояний, которые вызывают симптомы, похожие на болезнь Паркинсона.
Беседа врача с пациентом (анамнез) и физико-неврологический осмотр имеют важное значение для диагностики болезни Паркинсона. Основная цель дальнейших обследований - исключить другие причины симптомов. Болезнь Паркинсона (идиопатический синдром Паркинсона) может быть диагностирована только в том случае, если симптомы можно объяснить болезнью Паркинсона и никакие другие причины не могут быть обнаружены.
Особый случай: генетически обусловленная болезнь Паркинсона.
Как упоминалось в разделе «Причины», генетические формы болезни Паркинсона очень редки. Однако их можно определить с помощью молекулярно-генетического исследования. Такое обследование можно рассматривать, если:
- пациент заболевает болезнью Паркинсона до 45 лет или
- по крайней мере, двое родственников первой степени родства страдают болезнью Паркинсона.
В этих случаях есть подозрение, что болезнь Паркинсона вызвана мутацией гена.
Здоровые родственники пациента с генетической болезнью Паркинсона также могут пройти генетический тест. Таким образом можно определить, есть ли у них мутация запускающего гена. Такой генетический тест для оценки личного риска болезни Паркинсона может быть проведен только после того, как заинтересованное лицо получит подробную генетическую консультацию от специалиста.
Течение болезни и прогноз
Идиопатический синдром Паркинсона - прогрессирующее заболевание, которое еще не излечено. В зависимости от симптомов врачи различают четыре типа курсов:
- Акинетико-ригидный тип: в основном неподвижность и ригидность мышц, тремор почти отсутствует или отсутствует вовсе.
- Тип преобладания тремора: основной симптом - тремор (тремор).
- Тип эквивалентности: неподвижность, скованность мышц и тремор примерно одинаковы.
- Моносимптомный тремор в покое: тремор в покое - единственный симптом. Очень редкая форма.
Помимо формы течения, важную роль при болезни Паркинсона играет возраст начала: на течение и прогноз влияет то, разовьется ли болезнь в относительно молодом возрасте (например, с 40 лет) или в более старшем возрасте.
У более молодых пациентов гораздо более вероятно, что лекарство Паркинсона вызывает двигательные нарушения (дискинезию) и колебания действия. Это особенно верно в отношении акинетически-ригидного типа Паркинсона, для которого типично раннее начало болезни. Вместо этого у этих пациентов хорошо работает L-допа.
Иное дело с типом преобладания тремора: пациенты относительно плохо реагируют на L-допа. С другой стороны, болезнь Паркинсона у них прогрессирует медленнее, чем у других форм болезни. Таким образом, наиболее благоприятный прогноз имеет тип тремордоминаза.
Болезнь Паркинсона: продолжительность жизни
В середине 1970-х годов были разработаны современные лекарства от болезни Паркинсона, такие как леводопа. Это изменило прогноз для «настоящей» (идиопатической) болезни Паркинсона: продолжительность и качество жизни пациентов улучшились благодаря новым активным ингредиентам. Согласно статистике, оптимально пролеченный сегодня пациент с болезнью Паркинсона имеет почти такую же продолжительность жизни, как и здоровый человек того же возраста: если кому-то поставили диагноз болезни Паркинсона сегодня в возрасте 63 лет, он все еще может рассчитывать на 20 лет жизни. Для сравнения: в середине прошлого века пациенты жили в среднем чуть более девяти лет после постановки диагноза.
Увеличение продолжительности жизни при идиопатическом синдроме Паркинсона связано с тем, что современные препараты в значительной степени устраняют основные жалобы пациентов. В прошлом такие жалобы часто приводили к осложнениям, которые затем приводили к преждевременной смерти пациента. Пример: пациенты с болезнью Паркинсона, которые едва могли двигаться (акинезия), часто были прикованы к постели. Такой постельный режим значительно увеличивает риск таких опасных заболеваний, как тромбоз или пневмония.
Увеличение продолжительности жизни, как это описано здесь, относится только к идиопатическому синдрому Паркинсона (= «классическая болезнь Паркинсона»). Атипичные синдромы Паркинсона, при которых больные не реагируют или почти не реагируют на лечение L-допа, обычно прогрессируют быстрее. У них обычно гораздо худший прогноз.
Дополнительная информация
Рекомендации по книгам:
- Болезнь Паркинсона - тетрадь: оставайтесь активными с помощью двигательных упражнений (Эльмар Трутт, 2017, TRIAS)
- Болезнь Паркинсона: руководство для пострадавших и их родственников (Виллибальд Гершлагер, 2017, Facultas / Maudrich)
Руководящие указания:
- Руководство S3 «Идиопатический синдром Паркинсона» Немецкого общества неврологов (по состоянию на 2016 г.)
Группы самопомощи:
Немецкая ассоциация болезни Паркинсона e.V .:
https://www.parkinson-vereinigung.de